La semilla de pescado es el componente más importante para la piscicultura. Los recursos de agua dulce de nuestro país para la piscicultura se estiman en 2,85 millones de hectáreas de estanques y tanques. Además de esto, otros 2,05 millones de hectáreas de área de agua están disponibles en forma de embalses o lagos. Se ha estimado que se necesitarían casi 14.250 millones de alevines para sembrar incluso los 2,85 millones de hectáreas disponibles en la actualidad con una tasa de carga conservadora de 5000 alevines / ha. La producción actual es de 15007 millones de alevines. Aparte de esto, Se requiere al menos una cantidad adicional de 4100 millones de alevines para sembrar el área disponible de lagos y embalses con una carga promedio de 2000 alevines / ha. Esto indica que es necesario criar a los alevines para almacenar los recursos hídricos disponibles.
La semilla de pescado se obtiene de tres fuentes:fluvial, criaderos y criaderos. La recolección de semillas de fuentes fluviales era una práctica ancestral. Este método es agotador y obtenemos la mezcla de semillas de pescado deseadas y no deseadas. Los criaderos son la mejor forma de obtener semillas de peces. A parte de estos, La cría de bundh también es un buen método para recolectar semillas de peces creando un hábitat natural.
Los diferentes sistemas fluviales de la India presentan variaciones con respecto a la distribución y abundancia de su fauna ictícola. Esto se debe principalmente a sus condiciones ecológicas individuales, como gradiente, terreno, fluir, profundidad, temperatura, sustratos, etc. Los ríos del norte son perennes y sustentan ricas pesquerías comerciales. Excepto por las regiones deltaicas, la pesca de los ríos peninsulares es pobre tanto en el tramo medio como en el alto.
1 I norte du C mi D B r eed I norte gramo T mi C h no l o gramo y
Las carpas se reproducen en aguas que fluyen como ríos. Naturalmente, nunca se reproducen en aguas confinadas. La semilla recolectada de recursos naturales es generalmente un stock mixto con variedades deseables e indeseables. La separación de las semillas deseables del material mezclado es un gran problema. Debido al manejo, las variedades deseables pueden morir. Si se encuentra alguna semilla de pez depredador, dañan la semilla de pescado deseable. Otro gran problema es nunca obtener el número requerido en la colección natural. La disponibilidad de semilla pura es muy difícil. Para superar todos estos problemas, la cría inducida es una técnica excelente para obtener semillas de peces puras y necesarias. Tiene varias ventajas. Con la cría inducida se pueden obtener semillas puras de especies deseables. Supongamos que la semilla de rohu es necesaria, sólo se puede producir semilla de rohu en un par de días. Con esta técnica se puede producir el número requerido de semillas. Supongamos que una piscifactoría necesita 1 crore de semillas de pescado, este número se puede producir muy fácilmente en menos tiempo. No surgen los problemas de identificación y segregación de semillas. Esta técnica es muy sencilla. Se pueden producir semillas sanas. Los peces pueden desovar más de una vez en un año. La hibridación es posible.
En técnicas de cría inducida, Se utilizan cuatro tipos principales de materiales para administrar inyecciones a los peces:extracciones de la glándula pituitaria, HCG, ovaprim y ovatide.
Indiana tu ce D Breedin gramo ingenio h Pi t uitar y Glan D Extr a ctio norte
La cría de peces mediante la extracción de la glándula pituitaria es una forma eficaz y confiable de obtener semillas puras de peces cultivables y se practica hoy a una escala bastante extensa en la India, así como en muchos otros países del mundo. Consiste en inyectar a peces machos y hembras maduras con extractos de glándulas pituitarias extraídas de otros peces maduros.
H istori C a l atrás gramo ronda:
Se informa que el concepto actual del papel de la pituitaria en la reproducción de vertebrados se originó a partir de los experimentos de Aschheim y Zondek en 1927 cuando descubrieron que los implantes hipofisarios aceleraban el desarrollo sexual de ratones hembra. Tres años despues, en 1930, Houssay de Argentina realizó el primer experimento de este tipo en un pez. Inyectó un pequeño bagre vivíparo, Cresterodon decammaculatus con extractos de glándula pituitaria preparados a partir de otro pescado, Prochilodus platensis provoca el nacimiento prematuro de crías en desarrollo. En 1934, Von Ihring pudo desarrollar una técnica exitosa en ciertos peces de estanque brasileños que se hicieron desovar inyectándolos con una suspensión de glándulas pituitarias frescas recolectadas de otras especies de peces menos valiosas. Los brasileños, por lo tanto, fueron los primeros en utilizar con éxito la técnica de la cría de peces a través de la hipofisación. En 1937, El científico ruso Gerbiskii logró inducir un número significativo de esturiones, Acipenser stellatus.
India es el tercer país del mundo en hacer de la técnica una parte integral de su programa de piscicultura. El primer intento de hipofisación en la India fue realizado por Hamid Khan en 1937 cuando intentó inducir el desove en Cirrhinus mrigala mediante la inyección de la glándula pituitaria de los mamíferos. El siguiente intento fue realizado por Hussain en 1945 con ciertas hormonas como 80-120 RV Prolan y Antuitrin-S en la hembra Labeo rohita y Cirrhinus mrigala. En 1955, Hiralal Choudhuri logró inducir el desove en Esomus danricus mediante inyección intraperitonal de extracto pituitario de Catla catla. También tuvo éxito en la cría de Pseudotropius atherinoides. Ramaswamy y Sunderaraj lograron reproducirse en Heteropneustes fossilis y Clarias batrachus en 1955 y 1956 respectivamente. El primer éxito en la cría inducida de las principales carpas indias mediante hipofisación se logró en 1957 por Hiralal Chaudhuri y Alikunhi en CIFRI. Cuttack.
Fis h PAG I tuit a r y Gla norte D :
La glándula pituitaria del pez es una pequeña cuerpo suave y color blanco cremoso. Es más o menos redondo en las carpas. Se encuentra en el lado ventral del cerebro (Fig. 3.1) detrás del quiasma óptico en una concavidad del piso de la caja cerebral, conocido como Sella turcica y encerrado por una fina membrana llamada duramater. En pocos peces está unido al cerebro por un tallo delgado, conocido como el tallo infundibular. Basado en el tallo infundibular, las glándulas se clasifican en dos tipos, a saber, platybasic - sin tallo, tienen un receso infundibular abierto y leptobásico - con tallo, han borrado el receso infundibular. El tipo leptobásico de glándulas pituitarias se encuentra en las carpas y el tipo platibásico que se encuentra en los channidae y nandidae. El tamaño y el peso de la glándula varía según el tamaño y el peso del pez. En Labeo rohita, el peso medio de la glándula pituitaria es de 6,6 mg en 1-2 kg de pescado, 10,3 mg en 2-3 kg de pescado, 15,2 mg en pescado de 3-4 kg y 18,6 mg en pescado de 4-5 kg.
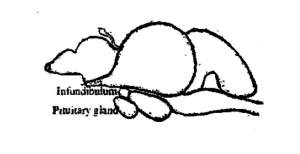
La glándula pituitaria secreta las hormonas gonadotrópicas, FSH u hormona estimulante folicular, y LH u hormona luteinizante. Ambas hormonas se secretan durante todo el año, pero la proporción en la que se secretan está directamente relacionada con el ciclo de madurez gonadal. La FSH provoca el crecimiento y la maduración de los folículos ováricos en las hembras y la espermatogénesis en los testículos de los machos. La LH ayuda a transformar los folículos ováricos en cuerpo lúteo en las mujeres y promueve la producción de testosterona en los hombres. Estas hormonas no son específicas de una especie, es decir., una hormona obtenida de una especie es capaz de estimular las gónadas de otro pez. Sin embargo, existe una gran variabilidad en su efectividad en diferentes especies. Los experimentos realizados sobre la cría inducida de peces han demostrado claramente la eficacia relativa de los extractos de pituitaria de pescado sobre las hormonas de la pituitaria de los mamíferos. hormonas sexuales y varios esteroides. Esta es la razón por la que la pituitaria de los peces se utiliza ampliamente hoy en día en el trabajo de cría de peces en todo el mundo.
Collecti o norte o F Pituitar y Glándula :
El pez que dona la glándula pituitaria, es decir, el pez del que se extrae la glándula pituitaria se denomina pez donante. El éxito en la cría inducida de peces depende en gran medida de la selección adecuada de los peces donantes. La glándula debe recolectarse preferiblemente de peces grávidos completamente maduros, ya que la glándula es más potente en el momento de la reproducción o justo antes del desove. La potencia de la glándula disminuye después del desove. Las glándulas recolectadas de peces inmaduros o agotados generalmente no dan resultados satisfactorios. También se ha encontrado que las glándulas en peces de reproducción inducida recolectadas inmediatamente después del desove son efectivas y pueden usarse para la reproducción de otros peces. El momento más adecuado en la India para la recolección de glándulas pituitarias de las principales carpas es durante los meses de mayo a julio, ya que la mayoría de las carpas alcanzan etapas avanzadas de madurez durante este período. Dado que la carpa común, Cyprinus carpio es un criador perenne, sus individuos maduros pueden obtenerse casi todo el año para la recolección de glándulas. Por lo general, se prefiere que las glándulas se recolecten de peces recién sacrificados, pero también se utilizan las recolectadas de especímenes conservados en hielo.
Se adoptan varias técnicas para la recolección de glándulas pituitarias en diferentes países. En India, La técnica comúnmente adoptada de recolección de glándulas es cortar el cuero cabelludo del cráneo del pez con un golpe oblicuo de un cuchillo de carnicero. Después de que se quita el cuero cabelludo, la materia gris y las sustancias grasas que se encuentran sobre el cerebro se limpian suavemente con un trozo de algodón. El cerebro así expuesto se extrae cuidadosamente separándolo de los nervios. En la mayoría de los ciprínidos, cuando se levanta el cerebro, la glándula se queda en el suelo de la caja del cerebro. La duramadre que cubre la glándula se extrae luego con cuidado con una aguja fina y unas pinzas. La glándula expuesta se recoge intacta sin causarle ningún daño porque las glándulas dañadas y rotas dan como resultado la pérdida de potencia.
Las glándulas también se recolectan a través del foramen magnum. Está, De hecho, un método mucho más fácil de extracción de glándulas que comúnmente practican los profesionales para la recolección a gran escala en mercados de pescado abarrotados y ruidosos. En este método de recolección de glándulas, se requiere que el pescado sea esencialmente decapitado. En los mercados Las glándulas se obtienen de las cabezas de pescado que ya cortan los minoristas. En las cabezas de pescado cortadas, el foramen se puede ver claramente desde atrás que contiene materia gris y sustancias grasas. El cerebro se encuentra en los lados ventrales del foramen. Por sacar la glándula, La sustancia gris y las sustancias grasas se eliminan primero insertando el extremo romo del fórceps en el foramen y extrayendo toda la materia sin perturbar el cerebro. El cerebro se levanta con cuidado y se empuja hacia adelante o se saca del agujero. La glándula que se encuentra en el piso de la caja del cerebro se levanta con un par de pinzas finas. Un trabajador experimental logra fácilmente recolectar alrededor de 50-60 glándulas en una hora adoptando esta técnica de recolección.
PAG reserva o F Pituit a r y Glándula s :
Si las glándulas recolectadas no están diseñadas para usarse en ese momento, deben conservarse. Debido a su naturaleza glicoproteica o mucoproteica, son susceptibles de una acción enzimática inmediata. Las glándulas pituitarias se pueden conservar mediante tres métodos:alcohol absoluto, acetona y congelación. En la India se prefiere la preservación de la glándula pituitaria del pescado en alcohol absoluto. Es más, los experimentos realizados hasta ahora con glándulas conservadas con alcohol en las principales carpas de la India han dado resultados más positivos que con glándulas conservadas con acetona.
Las glándulas después de la recolección se ponen inmediatamente en alcohol absoluto para desgrasar y deshidratar. Cada glándula se guarda en un frasco separado marcado en serie para facilitar la identificación. Después de 24 horas, las glándulas se lavan con alcohol absoluto y se mantienen nuevamente en alcohol absoluto fresco contenido en botellas de color oscuro y se almacenan a temperatura ambiente o en un refrigerador. El cambio ocasional de alcohol ayuda a mantener las glándulas en buenas condiciones durante períodos más prolongados. Para evitar que la humedad penetre en los viales, pueden guardarse dentro de un desecador que contenga algo de cloruro de calcio anhidro. Es preferible guardar las glándulas en el frigorífico. Se pueden almacenar en el frigorífico hasta 2-3 años y a temperatura ambiente hasta un año.
La acetona también es un buen conservante. En este método, poco después de la recolección, las glándulas se mantienen en acetona fresca o en acetona enfriada con hielo seco dentro de un refrigerador a 100 C durante 36-48 horas. Durante este período, la acetona se cambia 2-3 veces en intervalos de aproximadamente 8-12 horas para un desengrase y deshidratación adecuados. Luego se extraen las glándulas de la acetona, se pone un papel de filtro y se deja secar a temperatura ambiente durante una hora. Luego se almacenan en un refrigerador a 100 C, preferiblemente en un desecador cargado con cloruro de calcio o cualquier otro agente de secado. La preservación de glándulas en acetona se practica principalmente en la URSS y EE. UU.
PAG reparación o F Pituita r y Gl a norte D mi extraer :
Luego se pesan las glándulas conservadas. Esto es esencial para la determinación precisa de la dosis a administrar de acuerdo con el peso de los reproductores. El peso de la glándula puede tomarse individualmente o en grupo. Para obtener un peso más preciso, una glándula debe pesarse exactamente después de dos minutos de su remoción del alcohol.
El extracto de pituitaria debe prepararse justo antes del momento de la inyección. La cantidad de glándula necesaria para la inyección se calcula al principio a partir del peso del reproductor a inyectar. A continuación, se seleccionan las glándulas y se extrae de los viales la cantidad necesaria de glándulas. Se deja evaporar el alcohol, si las glándulas son conservadas en alcohol. Las glándulas secas con acetona se extraen inmediatamente de los viales para su maceración.
A continuación, las glándulas se maceran en un homogeneizador de tejidos añadiendo una cantidad medida de agua destilada o solución de sal común o cualquier solución fisiológica que sea isotónica con la sangre del pez receptor. Los resultados más exitosos de la cría inducida en las principales carpas de la India se han obtenido hasta ahora con agua destilada y una solución de sal común al 0,3%. La concentración del extracto generalmente se mantiene en el rango de 1-4 mg de glándula por 0.1 ml de medio, es decir, a razón de 20-30 g. de la glándula en 1,0 ml de medio. Después de la homogeneización, la suspensión se transfiere a un tubo de centrífuga. Mientras se transfiere, El homogeneizado debe agitarse bien para que las partículas de glándula sedimentadas que se mezclan con la solución entren en el tubo de centrífuga. El extracto del tubo se centrifuga y el líquido sobrenadante se introduce en una jeringa hipodérmica para inyección.
El extracto de pituitaria también se puede preparar a granel y conservar en glicerina (1 parte de extracto:2 partes de glicerina) antes de la temporada de cría de peces para evitar la molestia de preparar el extracto cada vez que se inyecta. El extracto de caldo debe almacenarse siempre en nevera o en hielo.
T mi C h niq tu mi o F B ree D En g :
La operación de cría inducida de las principales carpas se reanuda cuando comienza el monzón regular, los peces maduran completamente y la temperatura del agua baja. Hembras teniendo una ronda, Se seleccionan para la reproducción un abdomen blando y abultado con un orificio de ventilación rojizo hinchado y machos con lecha que rezuma libremente. Un criador macho también se puede distinguir fácilmente por la rugosidad en la superficie dorsal de sus aletas pectorales.
1 . Hacer s ag mi o F pitui t Arkansas y extr a C t :
El aspecto más importante de la cría inducida de peces es la evaluación de las dosis adecuadas de extracto de pituitaria. La potencia de la glándula varía según el tamaño y las etapas del desarrollo sexual del donante. así como la especie del pez donante, tiempo de recolección de glándulas y su adecuada conservación. La dosis de la glándula pituitaria se calcula en relación con el peso de los reproductores a inyectar. También se ha observado que dosis idénticas a reproductoras de pesos similares pueden dar resultados contradictorios debido a la diferencia en la madurez de las gónadas. Incluso las dosis elevadas de hormonas pueden no ser efectivas si las gónadas se encuentran en la etapa de reabsorción. Mediante una cuidadosa selección de los reproductores y la administración de un peso conocido de extracto de glándula pituitaria por kg de peso corporal de los reproductores, se puede obtener una reproducción exitosa.
Los experimentos de estandarización de dosis indican que la administración de una dosis baja preliminar en la reproductora seguida de una dosis efectiva más alta después de 6 horas resulta más exitosa que una dosis única de eliminación. Se ha encontrado útil una sola dosis alta cuando los criadores están en condiciones ideales y el clima es favorable. Rohu responde bien a dos inyecciones, mientras que catla y mrigal tanto a una como a dos inyecciones.
Una dosis inicial a razón de 2-3 mg. de glándula pituitaria por kg de peso corporal de los peces se administra únicamente a la reproductora. Los criadores machos no requieren ninguna dosis inicial, si supuran leche al presionar levemente el abdomen. Dos machos contra cada hembra forman un conjunto de cría. Para hacer un buen juego a juego, el peso de los machos juntos debe ser igual o mayor que el de la hembra. En caso de que la condición de cualquiera de los dos machos no se encuentre en la etapa de exudación libre, se puede administrar una inyección inicial al macho a razón de 2-3 mg / kg de peso corporal. Después de 6 horas, se administra una segunda dosis de 5-8 mg / kg de peso corporal a la hembra, mientras que ambos machos reciben la primera o la segunda dosis a razón de 2-3 mg / kg de peso corporal. Se pueden realizar ligeras alteraciones en las dosis dependiendo de la condición de madurez de los criadores y los factores ambientales predominantes. En ausencia de un equilibrio químico, 1-3 glándulas pituitarias son eficaces para un par de peces.
2 . METRO mi sin embargo D o F inyección :
Las inyecciones intracraneales se prefieren en la URSS y las intraperitoneales en EE. UU. Y Japón. La inyección intramuscular es la práctica más común en India. La inyección intramuscular es menos riesgosa en comparación con los otros métodos. Las inyecciones intraperitoniales generalmente se administran a través de las regiones blandas del cuerpo, generalmente en la base de la aleta pélvica o, a veces, en la base de la aleta pectoral. Pero existe cierto riesgo de dañar los órganos internos, especialmente las gónadas distendidas cuando se administra una inyección intraperitonial en peces completamente maduros.
Las inyecciones generalmente se administran en el pedúnculo caudal o en las regiones de los hombros cerca de la base de la aleta dorsal. Mientras administraba inyecciones a las carpas, la aguja se inserta debajo de una escala manteniéndola paralela al cuerpo del pez al principio y luego se perfora en el músculo en ángulo. No existe una regla estricta sobre el momento de la inyección. Las inyecciones se pueden administrar a cualquier hora del día y de la noche. Pero dado que la temperatura baja es útil y la noche sigue siendo comparativamente más tranquila, las inyecciones generalmente se administran al final de la tarde o en la noche con horarios
Semilla Producción T tecnologías 33
tan ajustado que el pez puede usar la tranquilidad de la noche para desovar sin ser molestado.
La jeringa hipodérmica más conveniente utilizada para este propósito es una jeringa de 2 cc con graduaciones de división de 0,1 cc. El tamaño de la aguja de la jeringa depende del tamaño de los reproductores que se inyectarán. La aguja No. 22 se usa convenientemente para carpas de 1-3 kg, El No. 19 para carpas más grandes y el No. 24 se puede usar para carpas más pequeñas.
El uso de anestésicos durante la inyección aumentaría significativamente la supervivencia de los peces reproductores. Los anestésicos de uso común son MS 222 y Quinaldine. Puede añadirse MS 222 al agua en dosis de 50-100 mg / litro. Se puede introducir en la boca del pescado un rollo de algodón empapado en 0,04 M de esta solución. La quinaldina se usa a razón de 50-100 mg / litro.
3 . B reedin gramo h ap a un D spa w ning :
Después de la inyección los criadores son liberados inmediatamente dentro de la hapa de cría. Una hapa de cría generalmente está hecha de tela fina del tamaño de 3,5 x 1,5 x 1,0 m para los criadores más grandes y de 2,5 x 1,2 x 1,0 m para los criadores que pesan menos de 3 kg. Todos los lados de la hapa de cría están cosidos y cerrados, excepto una parte en la parte superior para introducir a los criadores en el interior. Generalmente, un conjunto de criadores se libera dentro de cada hapa de cría, pero a veces, para ahorrar en material hipofisario, La cría comunitaria también se prueba reduciendo el número de machos reproductores. Después de la liberación de los peces, la abertura de la hapa está bien cerrada para que los criadores no puedan saltar y escapar. En lugar de hapas, También se pueden utilizar para la cría cisternas de cemento o piscinas de plástico del tamaño de hapas.
El desove ocurre normalmente dentro de las 3-6 horas posteriores a la segunda inyección. Poco después de la fertilización, los huevos se hinchan considerablemente debido a la absorción de agua. Los huevos fertilizados de las principales carpas aparecen como brillantes perlas de vidrio de transparencia cristalina, mientras que los no fertilizados se ven opacos y blanquecinos. El tamaño de los huevos de la misma especie de diferentes criadores varía considerablemente. Los huevos completamente hinchados de las principales carpas indias miden 2,5 mm de diámetro, el más grande es el de catla y el más pequeño de rohu. Los huevos de carpa son de tipo no flotante y no adhesivo. La yema no posee glóbulos de aceite. Las principales carpas indias tienen una gran capacidad para poner huevos. Su fecundidad, En promedio, es 3,1 lakh en rohu, 1-3 lakh en catla y 1,5 lakh en mrigal.
Los huevos en desarrollo se retienen en la zona de reproducción sin ser molestados durante un período de al menos 4-5 horas después del desove para permitir que los huevos se endurezcan adecuadamente con el agua. Después de este, los huevos se recogen de la hapa utilizando una taza y se transfieren a un balde con una pequeña cantidad de agua. A continuación, se extraen los criadores y se pesan para averiguar la diferencia antes y después del desove. Esto da una idea de la cantidad de huevos puestos. El volumen total y el número de huevos se pueden calcular fácilmente a partir del volumen conocido y el número de huevos de la taza de muestra. El porcentaje de huevos fertilizados también se evalúa en consecuencia mediante la realización de un muestreo aleatorio antes y después del desove. Esto da una idea de la cantidad de huevos puestos. El volumen total y el número de huevos se pueden calcular fácilmente a partir del volumen conocido y el número de huevos de la taza de muestra. El porcentaje de huevos fertilizados también se evalúa en consecuencia mediante la realización de un muestreo aleatorio.
4 . S tri pag alfiler gramo :
Sin embargo, las carpas chinas no se reproducen de forma natural y cuando lo hacen, el porcentaje de fertilización es generalmente muy bajo. Por lo tanto, se sigue el stripping (Fig. 3.1) o la inseminación artificial. La hembra se sostiene con la cabeza inclinada hacia arriba y la cola hacia abajo y el vientre hacia el recipiente. y los huevos se recogen en una artesa de esmalte o plástico presionando el cuerpo de la hembra. El pez macho se sujeta de manera similar y se exprime la leche en el mismo comedero. Luego, los gametos se mezclan lo antes posible mediante una pluma para permitir la fertilización. Luego, los huevos fertilizados se lavan unas cuantas veces con agua limpia para eliminar el exceso de lecha y se dejan reposar en agua dulce durante unos 30 minutos. Luego, los huevos están listos para ser liberados en los tanques de incubación.

T mi chn I qu mi o F h a tch I norte gramo t h mi mi ggs :
Los huevos recolectados de las hapas reproductoras se transfieren a las hapas de incubación. Una hapa para incubar consta de dos piezas separadas de hapas, el hapa exterior y el hapa interior. La hapa interior es de menor tamaño y se coloca dentro de la hapa exterior. La hapa exterior está formada por una tela fina en el tamaño estándar de 2 x 1 x 1 m, mientras que la hapa interior está hecha de tela de mosquitero de malla redonda en las dimensiones de 1,75 x 0,75 x 0,5 m. Todas las esquinas de las hapas exterior e interior están provistas de bucles y cuerdas para facilitar la instalación. Alrededor de 75, 000 a 1, 00, 000 huevos se distribuyen uniformemente dentro de cada hapa interior. Los huevos eclosionan en 14-20 horas a un rango de temperatura de 24-310 C.El período de incubación, De hecho, es inversamente proporcional a la temperatura. Después de la eclosión, las crías escapan al hapa exterior a través de las mallas del hapa interior. La hapa interior que contiene las cáscaras de huevo y los huevos muertos que se retiran cuando se completa la eclosión. Las crías permanecen en la hapa exterior sin ser molestadas hasta el tercer día después de la eclosión. Durante este período, subsisten con los alimentos almacenados en su saco vitelino. Al tercer día se forma la boca y las crías comienzan el movimiento directivo y la alimentación. En esta etapa, se recolectan cuidadosamente de la hapa de eclosión exterior y se almacenan en viveros preparados.
Se ha encontrado que se podría inducir a las principales carpas indias a desovar dos veces en la misma temporada con un intervalo de dos meses. Los criadores, después del primer desove, se alimentan con tortas de maní y salvado de arroz en una proporción de 1:1 al 2,5 por ciento del peso corporal. Cuando ocurren condiciones climáticas favorables, maduran y están listas para desovar.
En D uce D Br mi edin gramo w I t h H.C. GRAMO .
Hoy en día, la extracción de la glándula pituitaria es una técnica bien establecida para la reproducción inducida en todo el mundo. Su uso a gran escala plantea los siguientes problemas con respecto a la disponibilidad y calidad de la glándula pituitaria (P.G). Suministro inadecuado de P.G., Alto costo, variabilidad en la potencia de las gonadotropinas hipofisarias y trampas por parte de P.G. proveedores. Para superar estos problemas, Se ha descubierto que la gonadotropina coriónica humana (H.C.G) es una alternativa para la glándula pituitaria. H.C.G. fue descubierto a principios de 1927 por Aschheim y Zondek. Extrajeron hormona de buena calidad con actividad gonadotrófica luteinizante de la orina de mujeres embarazadas. Los trabajadores rusos usaron gonadotropina coriónica por primera vez en 1964 con un nombre comercial como Choriogohin y obtuvieron buenos resultados con Loach. Bratanor (1963) y Gerbilski (1965) utilizaron H.C.G en carpas y truchas y lograron un gran éxito. Tang (1968) afirmó que cuando las carpas chinas fueron tratadas con pituitaria de pescado en combinación con C.G., aumentó la eficacia en la reproducción inducida. Una lectura de la literatura indica que H.C.G. es eficaz solo o en combinación con P.G. extraer en la inducción de varios peces en todo el mundo.
H.C.G. es una glicoproteína o sialoproteína, debido a las moléculas de carbohidratos unidas a las moléculas de proteína. Su función principal es mantener la producción de estrógeno y progesterona por el cuerpo lúteo. Es producida por la placenta y excretada a través de la orina durante las primeras etapas del embarazo (2-4 meses). H.C.G se compone de 2 subunidades ayb y tiene un tamaño molecular de 45, 000-50, 000 daltons. Tiene 17 aminoácidos, de la cual Alanina, prolina, serina la cistina y la histidina son importantes. Debido a la gran cantidad de aminoácidos, H.C.G. tiene un alto contenido en proteínas. El peso molecular se ha informado como 59, 000 por filtración en gel y 47, 000 por equilibrio de sedimentación.
Durante las primeras etapas del embarazo, H.C.G. es rico en orina de mujeres embarazadas. Se emplean varios métodos para la extracción de H.C.G. Aschheim y Zondek (1927) utilizaron etanol para la precipitación. Katzman y Caina utilizaron diferentes absorbentes. La extracción comercial de H.C.G crudo se realiza mediante filtración en gel.
La hormona estimulante del folículo (FSH) y la hormona luteinizante (LH) de la pituitaria desempeñan un papel importante en la reproducción normal de los peces, es decir, en la promoción del desarrollo de gónadas, crecimiento, madurez y desove. H.C.G es más o menos similar en carácter y función a F.S.H y L.H. Como la glándula pituitaria se utiliza para la cría inducida de peces, H.C.G también se puede utilizar para la maduración temprana de las gónadas. La superioridad de H.C.G sobre P.G se puede medir por los siguientes motivos. Los peces alcanzan la madurez más rápido con H.C.G., el desove de la temporada de reproducción se puede aumentar con H.C.G., H.C.G. asegura una mejor supervivencia del desove, reduce el intervalo de tiempo entre las dosis preparatorias y finales, H.C.G es más económico y tiene una larga vida útil, H.C.G está fácilmente disponible desde una fuente estándar, por lo tanto, es más confiable, Las inyecciones periódicas de H.C.G durante todo el año garantizan una mejor salud y un aumento de peso y desarrollo gonadal Se conoce la potencia de H.C.G (30 UI / mg), disponible en paquetes ordenados de pesos conocidos, no se trata de preservación, no puede ser espurio, Los peces tratados con H.C.G se pueden utilizar más de una vez para la reproducción inducida en la misma temporada, la tasa de mortalidad de las crías es insignificante, el consumo de la droga es menor durante las crías inducidas, H.C.G se puede utilizar como hormona del crecimiento y la absorción de huevos al final de la temporada de reproducción es comparativamente menor con la administración de H.C.G.
El H.C.G crudo está en forma de polvo y de color blanco grisáceo o amarillo claro. Se disuelve fácilmente en agua. La cantidad calculada de H.C.G crudo se lleva a un homogeneizador de tejidos y se agita durante 5-10 minutos con agua destilada medida. Se centrifuga durante 3-5 minutos. El líquido sobrenadante claro amarillento claro que contiene las hormonas H.C.G se toma y se inyecta inmediatamente. Cualquier retraso en el uso resultará en la pérdida de potencia.
En el caso de la carpa plateada (Hypophthalmichthyes molitrix), El uso de H.C.G es bastante exitoso. La dosis es de 4-6 mg / kg. peso corporal del hombre, y 6-8 mg / kg de peso corporal de la primera dosis y después de aproximadamente 6-7 horas, 10-12 mg / kg de peso corporal de la segunda dosis para hembras que dio buenos resultados. El uso exclusivo de H.C.G en la cría de las principales carpas de la India no ha dado resultados satisfactorios hasta ahora. Una combinación de 60-80% H.C.G y 40-20% P.G para las principales carpas y gramíneas de la India (Ctenopharyngodon idella) es exitosa. Los peces que son inducidos a reproducirse solo con H.C.G son salmonetes, Cyprinus carpio, Lctalurus punctatus, Oreochromis nilotica, Aristichthys nobilis, Misgurnus fossilis, Esox lucius y Epinephelus tauvina.
Un trabajo reciente muestra que la combinación de H.C.G y P.G. es más recomendable que H.C.G o P.G solo. Es necesario trabajar más para estandarizar la dosis de H.C.G para la reproducción inducida de las principales carpas y carpas chinas.
En D uce D Bree D en gramo w eso h O vapr I metro
Debido al problema de la potencia variable de las pituitarias, se probaron alternativas. Se han hecho intentos en varios países para utilizar los análogos de las hormonas luteinizantes - hormonas liberadoras (LH-RH) para la reproducción inducida de peces con diversos grados de éxito. Sin embargo, el éxito logrado con LH-RH no siempre fue consistente, además de su requerimiento de dosis más alta para la inducción del desove. Esta investigación histórica allanó el camino para el desarrollo de una tecnología simple y eficaz para la reproducción inducida de la mayoría de los peces cultivables. En un proyecto colaborativo conjunto, financiado por el Centro Internacional de Investigaciones para el Desarrollo, Canadá al Dr. Lin de China y al Dr. Peter de Canadá, Se llevaron a cabo una serie de investigaciones para desarrollar una tecnología confiable para la cría de peces. Sus investigaciones llevaron al desarrollo de una nueva técnica llamada método "LNPE", en el que un análogo de LH-RH se combina con un antagonista de la dopamina. Basado en el principio, M / s Syndel Laboratories Limited, Canadá ha fabricado un nuevo medicamento llamado ovaprim.
Ovaprim es un producto listo para usar y la solución es estable a temperatura ambiente. Contiene un análogo de 20 µg de hormona liberadora de gonadotropina de salmón (sGnPHa) y un antagonista de la dopamina, domperidona a 10 mg / ml. La potencia de ovaprim es uniforme y contiene sGnRHa, que se sabe que es 17 veces más potente que la LH-RH (Peter, 1987). El antagonista de la dopamina, También se informa que la domperidona utilizada en ovaprim es mejor que otro antagonista de uso común, pimozida. Ovaprim es un producto listo para usar y no requiere almacenamiento refrigerado, parece ser el agente de ovulación más conveniente y eficaz.
Este fármaco se administra a reproductores tanto machos como hembras simultáneamente en una sola dosis. a diferencia del extracto de pituitaria que se administra en dos dosis divididas. Esto reduce no solo el manejo de peces reproductores, sino que también ayuda a ahorrar una cantidad considerable de tiempo y mano de obra, lo que aumentará el costo de producción de semillas. Se encuentra que la respuesta de desove en las especies tratadas es superior a la de las especies inyectadas con extracto de pituitaria.
La eficacia de ovaprim para la cría inducida de carpas ha dado resultados muy alentadores en catla, rohu, mrigal, carpa plateada, la carpa herbívora, cabeza grande, etc. The effective dose required for various species of carps is found to vary considerably. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. En India, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
En D uce D br mi edin gramo w I t h o vati D mi
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Indiana tu ce D B reedin gramo ingenio h Ovop mi l
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Sin embargo, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, in India, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). En India, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
O t él r Su B sta norte ce s nosotros mi D F o r I norte duc mi D B r ee D en gramo
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R H analo gramo ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S t mi roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl o miph mi nordeste :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
mi s t I metro a t I o norte o F mi gramo gramo s :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B r ead I norte gramo o F C o metro mes norte C Arkansas pag :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 to 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.







