¿Qué tiene de importante el nitrógeno?
 En el mundo de la economía humana, política, y sociedad, hay muchas monedas diferentes, todos los cuales se intercambian por bienes. Esto podría ser aceite Dólares estadounidenses, Me gusta de Facebook o cookies de la abuela. El mundo natural tiene monedas similares:el comercio de oxígeno, carbón, y quizás la moneda más preciosa de todas: nitrógeno .
En el mundo de la economía humana, política, y sociedad, hay muchas monedas diferentes, todos los cuales se intercambian por bienes. Esto podría ser aceite Dólares estadounidenses, Me gusta de Facebook o cookies de la abuela. El mundo natural tiene monedas similares:el comercio de oxígeno, carbón, y quizás la moneda más preciosa de todas: nitrógeno .
El mundo entero lucha por ello cosecharlo honestamente, engañando por ello, y robándolo brutalmente. Es un elemento poderoso, requerido en las mayores cantidades para un buen crecimiento, defensa, y reproducción. Este artículo cubrirá qué es el nitrógeno, donde ocurre en el sistema, y cómo interactúa con los otros elementos de la acuaponía. También discutiremos cómo identificar una deficiencia de nitrógeno.
Nitrógeno en acuaponía
Como ya he mencionado, El nitrógeno es uno de los nutrientes más importantes de su sistema acuapónico. Ocurre en varias formas en el mundo natural, pero por ahora, nos centraremos en la más relevante:la proteína.
La proteína se construye a partir de aminoácidos, que a su vez se construyen a partir de nitrógeno. Todas las plantas y animales contienen proteínas, y cuando mueran, otros organismos los consumen y eliminan estas proteínas para obtener energía. Por lo tanto, el nitrógeno ingresa al cuerpo en forma de alimento proteínico.
El ciclo del nitrógeno
Cuando los animales terrestres consumen proteínas, eventualmente las descomponen en aminoácidos y luego en amoníaco. El amoníaco (NH3) es un material desagradable, es muy tóxico, y la mejor manera de deshacerse del exceso de amoníaco es excretarlo. Entonces, en animales terrestres, el amoníaco se convierte en una sustancia química llamada urea y se excreta en la orina.
El nitrógeno se produce en los sistemas acuapónicos de la misma forma. Entra en forma de alimento para peces. Los peces consumen la comida pero el proceso es más sencillo; los microbios en sus vientres descomponen las proteínas en amoníaco y amonio. El amoníaco generalmente está presente como amonio (NH4 +) que se mueve a través de las membranas celulares de los peces y finalmente se difunde en el agua. No se necesita conversión adicional. Para el pescado, de todas formas.
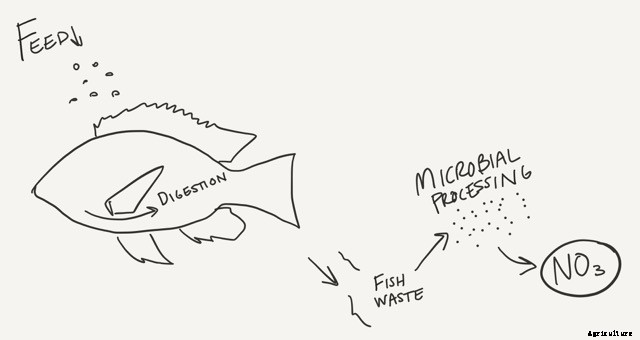
Dependiendo del pH de su agua, el amonio puede permanecer como amonio o convertirse en amoníaco, que puede ser muy peligroso. El amoniaco no tiene ningún cargo, por lo que los peces tienen dificultades para mantenerlo fuera de sus cuerpos. Cuando esto pasa, los peces están envenenados.
Entonces, una vez que el amoníaco esté en la solución, eso debe transformarse o acabará matando a los peces. Hay dos formas de hacer esto:alterar su pH para favorecer el amonio (que no se sugiere) o convertir el amoníaco en nitratos. La serie de transformaciones de una forma orgánica (amoníaco) a una forma disponible para las plantas (nitrato), y el siguiente paso del ciclo, se denomina nitrificación.
Nitrificación
La nitrificación es el proceso que impulsa a la mayoría de los sistemas acuapónicos. Esencialmente, la nitrificación convierte el amoníaco y el amonio en nitrato útil. Esto sucede en dos procesos:convertir el amoníaco en nitrito, y convertir el nitrito en nitrato.
En casi todos los entornos (excepto los anaeróbicos), el amoníaco se transforma rápidamente en nitrito (NO2-). Microbios — o bacterias nitrificantes - en el suelo o solución agregue oxígeno a (o oxidar ) el amoniaco. Mientras esto sucede, los microbios obtienen la energía para fijar el carbono (romper el carbono del dióxido de carbono para formar células). Además, Se producen iones de hidrógeno (H +), los mismos iones que se miden en la prueba de pH y hacen que el agua se vuelva ácida.
Este proceso se ha atribuido tradicionalmente a una bacteria llamada Nitrosomonas. Investigaciones recientes muestran que hay muchos cientos, si no miles de especies diferentes además de Nitrosomonas que también hacen este trabajo.
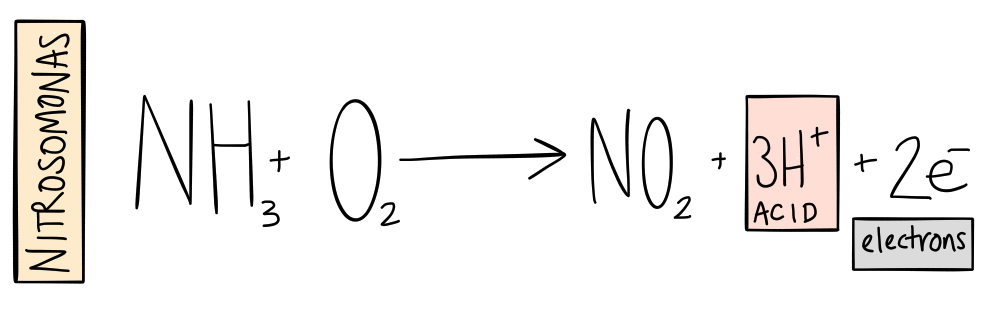
Ese es el primer paso.
El siguiente paso del ciclo es convertir ese nitrito en nitrato. El nitrito también es bastante tóxico, por lo que nunca querrá demasiado en su sistema. Afortunadamente, representa mucha energía almacenada para otras bacterias [nitrificantes]. Estas bacterias oxidan el nitrito y utilizan la energía del proceso para fijar más carbono. Suena familiar, excepto que esta vez el resultado es nitrato (NUMERO 3-). El nitrato es una forma de nitrógeno relativamente no tóxica que las plantas pueden absorber y utilizar para construir células.
La bacteria más comúnmente reconocida por realizar esta reacción química se llama Nitrobacter. De nuevo, sin embargo, La investigación indica que hay muchas bacterias que participan en esta reacción además de Nitrobacter.
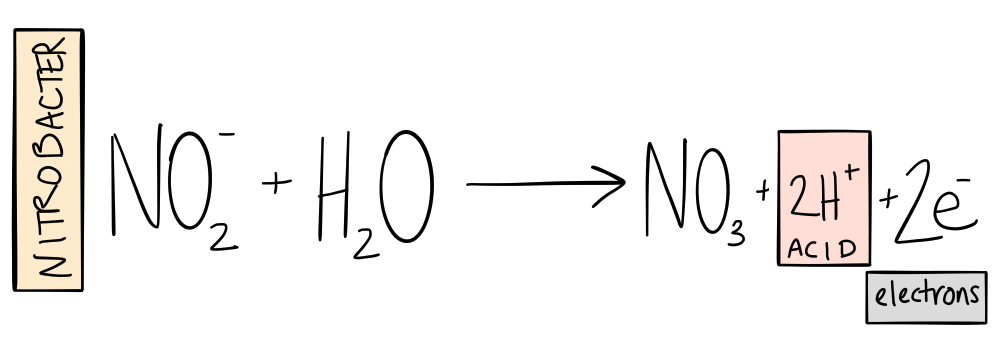
A medida que las bacterias oxidan el amoníaco y el nitrito, liberan iones de hidronio en la solución, haciendo que el sistema sea más ácido. (Para las personas que desean ejecutar sus sistemas en el rango de pH óptimo para la disponibilidad de nutrientes, la nitrificación es el proceso más importante para reducir el pH). Esto indica por qué la solución de los sistemas más antiguos tiende hacia valores de pH más ácidos.
El nitrógeno está disponible en una amplia variedad de valores de pH, por lo que el pH importa menos cuando se trata de la disponibilidad de nitrógeno.
"... la nitrificación es el proceso más importante para reducir el pH".
Eficiencia de nitrificación y pH
La velocidad a la que cambia el pH de una solución, sin embargo, puede influir en la forma de nitrógeno disponible (ver el video sobre amoníaco / amonio y pH) así como en la eficiencia de la nitrificación. Si las bacterias nitrificantes no tienen tiempo para adaptarse a los cambios en los niveles de pH (como casi cualquier otra variable del sistema), la nitrificación sufrirá.
De hecho, la nitrificación avanza bien a valores de pH bajos siempre que se dé tiempo a la ecología nitrificante para adaptarse. Las bacterias nitrificantes son generalmente ineficaces cuando se trata de cambiar las variables del sistema. A menudo mueren o quedan inactivos cuando se exponen a demasiada luz. fluctuaciones de temperatura, fluctuaciones en la salinidad y el pH, así como muchos otros cambios en su entorno.
Bacterias nitrificantes en acuaponia
El equilibrio percibido entre el pH y la eficiencia de la nitrificación se ha basado en el supuesto de que la actividad de la nitrificación en los sistemas acuapónicos era principalmente una función de dos grupos diferentes de bacterias: Nitrosomonas spp., y Nitrobacter spp.
En ensayos de laboratorio, estas especies bacterianas han mostrado sensibilidad al pH, con cambios en el pH que afectan su capacidad para oxidar amoniaco (Nitrosomonas) y nitrito (Nitrobacter). Recuerde que la mayoría de las bacterias nitrificantes (estudiadas al menos hasta ahora) no manejan bien las variables ambientales cambiantes. Es importante saber esto por dos razones:
- Cambiar su pH rápidamente reducirá su eficiencia de nitrificación.
- La mayoría de los nitrificantes son muy difíciles de eliminar del medio ambiente y del cultivo en un laboratorio.
¿Por qué necesito saber esto?
¿Qué tiene esto que ver con el debate sobre la nitrificación? Bien, El punto n. ° 1 nos dice que quizás muchos de los "fallos del sistema" atribuidos a la ejecución de un sistema con un pH demasiado bajo pueden en realidad atribuirse a una disminución del pH del sistema demasiado rápido. El punto # 2 nos dice que Nitrosomonas y Nitrobacter pueden no ser realmente el la mayoría nitrificantes importantes en los sistemas:son simplemente los grupos más fáciles de aislar y cultivar en una placa de Petri en un laboratorio.
¿Qué significa esto?
Básicamente, significa que las reglas estrictas y rápidas de la nitrificación pueden no ser tan estrictas y rápidas como se suelen comunicar. Existen muchos sistemas que ejecutan rangos de pH muy bajos con una gran eficiencia de nitrificación (incluido el nuestro). Puede ser que las especies de Nitrosomonas y Nitrobacter sean los principales nitrificantes en nuestro sistema, pero la realidad es que simplemente no lo sabemos. Lo que sí sabemos es que nuestra nitrificación es eficiente y excelente independientemente del pH de nuestro sistema.
Nitrificación en suelo
Para poner esto en perspectiva, Hay muchos suelos ácidos y ambientes marinos en todo el mundo donde la nitrificación ocurre en rangos de pH notablemente bajos. Muchos de los nitrificantes en estos entornos no son miembros de los grupos Nitrobacter o Nitrosomonas. Muchos de ellos son desconocidos. En una sola pala de tierra hay un estimado de 10, 000 especies diferentes de bacterias o aproximadamente el doble del número de bacterias conocidas actualmente por la ciencia.
Con eso en mente, Creo que no solo es posible, pero es probable que haya algunas bacterias bastante interesantes que realizan funciones nitrificantes en los sistemas acuapónicos de todo el mundo.
Vea nuestro video de BSA que detalla el área de superficie biológica, posiblemente el elemento de diseño de sistema más importante que fomenta la nitrificación.
Nitrato
 En todo caso, el producto final es nitrato (NO3-). Algunas plantas pueden absorber amonio y utilizarlo. Sin embargo, la mayoría prefiere el nitrato. En sistemas donde hay un exceso de amonio, las plantas tienden a ser más largas y, a menudo, son menos vendibles. Por otra parte, en sistemas con gran cantidad de nitratos, los problemas con los pulgones y otras plagas pueden ser más dramáticos, requiriendo más intervención. Por lo tanto, tenga en cuenta que los sistemas con demasiados nitratos pueden ver un aumento de los problemas de plagas.
En todo caso, el producto final es nitrato (NO3-). Algunas plantas pueden absorber amonio y utilizarlo. Sin embargo, la mayoría prefiere el nitrato. En sistemas donde hay un exceso de amonio, las plantas tienden a ser más largas y, a menudo, son menos vendibles. Por otra parte, en sistemas con gran cantidad de nitratos, los problemas con los pulgones y otras plagas pueden ser más dramáticos, requiriendo más intervención. Por lo tanto, tenga en cuenta que los sistemas con demasiados nitratos pueden ver un aumento de los problemas de plagas.
Nitrato, nitrito, y los niveles de amoníaco se pueden probar fácilmente con un kit de prueba de agua dulce, como éste. El nitrato se disuelve en la solución y las bacterias compiten instantáneamente por él, hongos algas y otras plantas. Todos estos organismos absorben nitratos y los utilizan en sus tejidos. Como las bacterias, hongos y mueren las algas, ese nitrógeno (a menudo en forma de proteína) vuelve a entrar en el sistema y el ciclo comienza de nuevo. Gran parte del nitrato sin embargo, está entregado, sano y salvo, a la zona de la raíz, donde las plantas de su sistema lo toman y lo usan para crecer.
Niveles ideales de nitrato
Si bien es peligroso tener niveles de amoníaco o nitrito muy por encima de 2 ppm y 1 ppm respectivamente, el nitrato a menudo puede correr muy por encima de 100 ppm (muy por encima de la tabla para muchas pruebas de nitrato) sin representar una amenaza para sus peces. Muchos sistemas hidropónicos funcionan con nitratos en el rango de 160 ppm. Las plantas a menudo pueden apreciar niveles incluso más altos que eso, pero el cultivador acuapónico debe encontrar un equilibrio entre las necesidades de los peces, la ecología del sistema (incluidas las plagas), y las necesidades de las plantas. Por esta razón, Recomiendo que la mayoría de los cultivadores acuapónicos disparen para mantener su nitrato en el rango de 40-80 ppm para bien crecimiento constante de la planta.
Mantener rangos de nitratos consistentes
Muchos sistemas tienen dificultades para mantener los niveles de nitrógeno, especialmente a medida que el sistema madura, las plantas crecen y la ecología del sistema se vuelve más compleja. Esto puede requerir que se aumente la alimentación para satisfacer el aumento de la demanda. Muchas personas inicialmente quieren aumentar la densidad de población, pero esto suele ser un error. En lugar de, aumentar las tasas de alimentación (¡pero no sobrealimentar!), y vea si se pueden lograr niveles más altos de nitrato con la misma cantidad de pescado.
Cómo identificar una deficiencia de nitrógeno

Dado que el nitrógeno es un nutriente móvil (se dirige a diferentes lugares dentro de la planta), las deficiencias afectan primero al crecimiento más viejo. Los síntomas de una deficiencia son clorosis total sin patrón en la hoja y retraso en el crecimiento. Lea nuestra Guía para principiantes sobre las deficiencias de nutrientes para obtener más información.
N-P-K
Además del pienso para peces, el nitrógeno ingresa al sistema a través de fertilizantes. Casi todos los fertilizantes tienen una clasificación NPK que le indica las concentraciones relativas de nitrógeno, fósforo, y potasio (en ese orden). Para el crecimiento vegetativo (el crecimiento de tallos, sale de, y raíces), El nitrógeno se requiere más que cualquier otro nutriente mineral.
Conclusión
De muchas maneras, el nitrógeno es el nutriente vegetal más importante, pero también el más simple. El siguiente nutriente de nuestra lista es el hierro, un nutriente delicado pero importante.

 En el mundo de la economía humana, política, y sociedad, hay muchas monedas diferentes, todos los cuales se intercambian por bienes. Esto podría ser aceite Dólares estadounidenses, Me gusta de Facebook o cookies de la abuela. El mundo natural tiene monedas similares:el comercio de oxígeno, carbón, y quizás la moneda más preciosa de todas: nitrógeno .
En el mundo de la economía humana, política, y sociedad, hay muchas monedas diferentes, todos los cuales se intercambian por bienes. Esto podría ser aceite Dólares estadounidenses, Me gusta de Facebook o cookies de la abuela. El mundo natural tiene monedas similares:el comercio de oxígeno, carbón, y quizás la moneda más preciosa de todas: nitrógeno . 

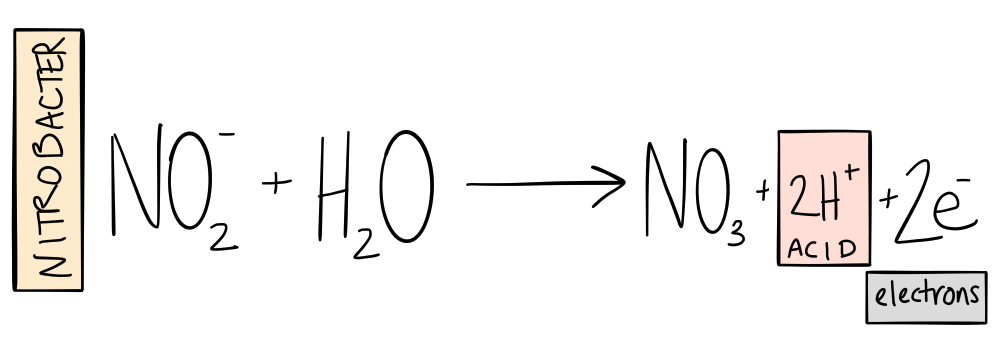
 En todo caso, el producto final es nitrato (NO3-). Algunas plantas pueden absorber amonio y utilizarlo. Sin embargo, la mayoría prefiere el nitrato. En sistemas donde hay un exceso de amonio, las plantas tienden a ser más largas y, a menudo, son menos vendibles. Por otra parte, en sistemas con gran cantidad de nitratos, los problemas con los pulgones y otras plagas pueden ser más dramáticos, requiriendo más intervención. Por lo tanto, tenga en cuenta que los sistemas con demasiados nitratos pueden ver un aumento de los problemas de plagas.
En todo caso, el producto final es nitrato (NO3-). Algunas plantas pueden absorber amonio y utilizarlo. Sin embargo, la mayoría prefiere el nitrato. En sistemas donde hay un exceso de amonio, las plantas tienden a ser más largas y, a menudo, son menos vendibles. Por otra parte, en sistemas con gran cantidad de nitratos, los problemas con los pulgones y otras plagas pueden ser más dramáticos, requiriendo más intervención. Por lo tanto, tenga en cuenta que los sistemas con demasiados nitratos pueden ver un aumento de los problemas de plagas. 



